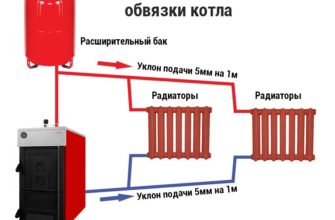
// Смеси водорода с кислородом и воздухом взрывоопасны и называются горючими газами. Наиболее распространена смесь с объемным соотношением 2: 1, что соответствует стехиометрии цепной реакции 2H2 + O2 = 2H2O + 483,2 кДж. Смеси H2 и O2 разного состава также взрывоопасны.
Горячие газы взрываются при нагревании, воздействии пламени или искр. При горении выделяется много тепла, температура пламени может достигать 2800 ° C.
Водородно-кислородные пламени, получаемые в горелках, конструкция которых исключает возможность взрыва, используются для газовой сварки и резки металлов, плавления кварца, платины и т. Д.
На школьных семинарах это явление демонстрируется в форме эксперимента под названием «Взрыв водорода в банке». Для этого перевернутая банка с отверстием заполняется водородом (например, из аппарата Киппа). Через несколько минут, когда водород вытеснил весь воздух в банке, отверстие открывается и в него помещается тлеющий факел.
При открытии водород, выходящий из сосуда, воспламеняется в виде небольшого пламени. По мере того, как воздух поступает в сосуд снизу, горение становится более турбулентным, с гудением и тонким скрипом. Когда в баллоне собирается достаточно воздуха, происходит громкий, но не угрожающий взрыв, и баллон подпрыгивает вверх, когда взрывается газовая смесь.
Сегодня поговорим о проблемах с расчетами. Последовательность использования
- Конкретно укажите условие проблемы.
- Составьте краткое изложение постановки задачи из двух частей: «Дано», «Найти», называя физические величины в соответствии с правилами IUPAC.
- Проанализируйте имеющуюся информацию на предмет избытка или недостатка. 23
- Запишите все физические величины, необходимые для решения проблемы, в поле «Данные».
- Решите задачу рационально в общем виде с однократной заменой числовых значений.
- По каждому действию должна быть подготовлена пояснительная записка.
- Выполняйте математические операции не только с числами, но и с единицами измерения.
- Введите числовое значение ответа, не превышающее точность наименьшего точного числа.
- Напишите полный ответ на проблемный вопрос без использования формул химических соединений.
Поэтому в таких задачах мы сначала используем уравнения, затем законы и расчеты.
Подумайте: какая масса и какое количество воды образуется после сжигания 8 г водорода. Как объяснить утверждение, что сжигание определенного количества водорода дает такое же количество воды?
Первое, о чем здесь нужно подумать, — это уравнение.
Согласно уравнению реакции, две молекулы водорода реагируют с одной молекулой кислорода, поэтому оптимальное соотношение водорода и кислорода составляет два к одному. Каково наше состояние реакции? Это газовая система, в которой реакция происходит в газовой сфере. Следовательно, если рассматривать вещества в системе в объемных пропорциях, можно сказать, что при сжигании определенного объема, например 1 л водорода, образуется 1 л водяного пара.
2H2 (газ) + O2 (газ) = 2H2O (газ)
Вторая часть решения — включить права на объяснение решения. Все это объясняется законом Авогадро, который гласит, что на 1 моль любого газа уходит 22,4 л.
Эта реакция протекает с уменьшением объема в 1,5 раза (из 3 моль исходных газообразных веществ (водорода и кислорода) образуется 2 моля газообразного продукта (водяного пара).
Если выразить это количественно, 2 моля водяного пара будут получены из 2 моль водорода. В нашем случае
Конкретизируем это для данной реакции:
n (H2) = m (H2) / M (H2) = 8/2 = 4 моль
n (H2O) = m (H2O) / M (H2O) = 72/18 = 4 моля.
Следовательно, при сжигании водорода образуется такое же количество водяного пара.
Обобщив законы, переходим к третьей части — расчетам. При расчете массы вещества естественно, что из 8 г водорода образуется 72 г воды. Это можно представить в виде диаграммы:
Дозирование — расчет массы водяного пара:
следовательно, x = (8 * 36) / 4 = 72 г.
Массовое отношение водорода к воде составляет 1: 9 (8: 72 = 1: 9). Все это объясняется в соответствии с законом Ломоносова (закон сохранения массы веществ). Таким образом, 9 частей массовой воды создаются из 1 части массового водорода.
Проблемы с газом Raderabis также часто появляются на физике. Одним из примеров является сгорание чистого водорода спокойного, равное пламени. Однако стехиометрическая смесь водорода и кислорода называется «легковоспламеняющийся газ», может быть зажечь не только пламя, но и искрой, даже с низкой энергией. В этом случае процесс сгорания проходит чрезвычайно быстро, громким взрывом, который субъективно подобран в качестве взрыва. Соответственно, можно предположить, что при стандартных условиях сгорание водорода в спонтанно проходит, то есть термодинамически приемлемо.
Что произойдет, если в результате взрыва в стандартных условиях баночка 30 г и внутренний объем 0,5 л летал вертикально вверх.
В этом случае используйте список уравнений и количеств:
- Уравнение энергии Гиббс: GO = & # 916; HO — T & # 916; так
2. Уравнение Mendelejewa-Clapeyron: PV = NRT
3. Изотермические условия процесса: RH = -EP
4 Уравнение потенциальной энергии (для расчета напора): Epot = — mgh